ГОСТ 25047-87 Устройства комплектные эксфузионные, инфузионные и трансфузионные однократного применения. Технические условия (с Изменениями N 1, 2, 3, 4)
ГОСТ 25047-87 Устройства комплектные эксфузионные, инфузионные и трансфузионные однократного применения. Технические условия (с Изменениями N 1, 2, 3, 4)
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
УСТРОЙСТВА КОМПЛЕКТНЫЕ ЭКСФУЗИОННЫЕ, ИНФУЗИОННЫЕ И ТРАНСФУЗИОННЫЕ ОДНОКРАТНОГО ПРИМЕНЕНИЯ
Disposable exfusion, infusion and transfusion sets. Specifications
МКС 11.040.20
ОКП 94 4477
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством медицинской и микробиологической промышленности
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 20.03.87 N 805
Изменение N 4 принято Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 17 от 22.06.2000)
За принятие изменения проголосовали:
5. Ограничение срока действия снято по протоколу N 3-93 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 5-6-93)
6. ИЗДАНИЕ (сентябрь 2003 года) с Изменениями N 1, 2, 3, 4, утвержденными в феврале 1989 г., январе 1990 г., феврале 1991 г., апреле 2002 г. (ИУС 5-89, 4-90, 5-91, 7-2002)
Настоящий стандарт распространяется на комплектные эксфузионные, инфузионные и трансфузионные устройства однократного применения (далее — устройства), предназначенные для взятия крови у донора, для вливания реципиенту растворов и переливания крови и ее компонентов, а также кровезаменителей и других трансфузионных сред из стеклянных и полимерных емкостей.
Стандарт устанавливает требования к устройствам, изготовляемым для потребностей национальной экономики и экспорта в страны с умеренным и тропическим климатом.
Устройства изготовляют в климатическом исполнении О2 по ГОСТ 15150 для работы при температуре от 5 до 45 °С в условиях клиник, больниц, в службе скорой помощи, в полевых условиях, в учреждениях службы крови.
Обязательные требования к качеству продукции, работы (процесса), услуг изложены в пп.1.2.3, 1.3.2, 1.3.4-1.3.12, 1.3.13 (в части стерильности), 1.3.14, 1.3.17, 1.3.18, 1.4.
(Измененная редакция, Изм.N 1, 4).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Устройства должны соответствовать требованиям настоящего стандарта и быть изготовлены по конструкторской и технологической документации, утвержденной в установленном порядке. Устройства, изготовляемые для экспорта, должны соответствовать также заказу-наряду внешнеторговой организации.
1.2.1. Устройства в зависимости от назначения следует изготовлять типов:
ВК — эксфузионные;
ПР — инфузионные;
ПК — трансфузионные;
КР — трансфузионно-инфузионные.
1.2.2. В зависимости от назначения и конструктивных особенностей устройства в пределах каждого типа подразделяют на виды, указанные на черт.1-12 приложения 1 и в табл.1.
(Измененная редакция, Изм.N 2, 4).
1.2.3. Основные размеры устройств должны соответствовать указанным на черт.1-12 приложения 1. Чертежи не определяют конструкцию устройств.
(Измененная редакция, Изм.N 4).
1.2.4. Перечень кодов ОКП устройств в полной номенклатуре приведен в приложении 2.
1.2.5. Обозначение вида устройства состоит из букв и четырех цифр. Буквы характеризуют тип устройства.
Цифры обозначают:
для устройств типа ВК первая цифра 1 указывает на число бутылок, в которые берут кровь, вторая цифра 0 смыслового значения не имеет;
для устройств типов ПР, ПК, КР первая цифра характеризует капельницу:
2 — полужесткая;
вторая цифра характеризует емкость, из которой ведут переливание:
3 — бутылка или контейнер.
Последние две цифры (после тире) для устройств всех типов указывают номер конструкции.
Пример условного обозначения устройства для переливания крови, кровезаменителей и инфузионных растворов
То же, для взятия крови в бутылку
(Измененная редакция, Изм.N 2).
1.3.1. Материалы, из которых должны быть изготовлены детали устройств, потребительская тара и полуфабрикаты, должны быть разрешены соответствующей организацией Минздрава.
1.3.2. Трубки и капельница должны быть изготовлены из материалов, позволяющих видеть невооруженным глазом пузырьки воздуха, уровень жидкости и последовательность каплепадения.
1.3.1, 1.3.2. (Измененная редакция, Изм.N 4).
1.3.4. Детали устройств не должны иметь механических повреждений и посторонних включений, влияющих на функциональные свойства.
1.3.5. Внутренняя поверхность основной части устройств должна быть практически свободна после фильтра от видимых механических частиц.
Допускается не более трех механических частиц.
(Измененная редакция, Изм.N 4).
1.3.6. Соединения деталей основной части устройства должны обеспечивать герметичность при минимальном внутреннем избыточном давлении 40 кПа.
1.3.7. Соединения трубок специальных игл диаметром 1,5 или 1,2 мм с головками должны выдерживать нагрузку при растяжении не менее 50 Н, соединения трубок специальных игл диаметром 0,8 мм — не менее 45 Н, а соединения всех других деталей устройства, кроме соединения инъекционной иглы с головкой типа «Рекорд» или «Луер», должны выдерживать нагрузку при растяжении не менее 20 Н после стерилизации.
(Измененная редакция, Изм.N 4).
1.3.8. Зажим должен обеспечивать регулирование тока жидкости от полного перекрытия до струйного истечения.
1.3.9. Инъекционный узел должен обеспечивать самозатягиваемость при шестикратном прокалывании иглой диаметром 0,8 мм в разных местах.
(Измененная редакция, Изм.N 2).
1.3.10. Устройство должно быть стерильным внутри, нетоксичным и апирогенным в течение не менее трех лет.
1.3.11. Потребительская тара с вложенным в нее устройством должна быть целостной.
(Измененная редакция, Изм.N 2).
1.3.12. Устройство не должно иметь перегибов и слипшихся участков трубок, которые могут препятствовать нормальному току жидкости.
1.3.13. Инъекционная игла диаметром 1,5 или 1,2 мм должна быть в индивидуальной таре, стерильна, иметь силиконовое покрытие. Допускается применять инъекционную иглу диаметром 0,8 мм для устройств типа ПР.
(Измененная редакция, Изм.N 4).
1.3.14. Фильтр воздуховода должен обеспечивать струйное истечение из бутылки и поступление жидкости в бутылку.
1.3.15. Устройства в транспортной таре должны обладать вибропрочностью и ударопрочностью в соответствии с ГОСТ 20790 для изделий группы 2.
1.3.16. Устройства должны быть работоспособными после воздействия температуры и влажности воздуха в процессе транспортирования в соответствии с ГОСТ 20790.
1.3.14-1.3.16. (Измененная редакция, Изм.N 2).
1.3.17. Капельно-фильтрующий узел должен обеспечивать удаление микрочастиц размером более 175 мкм с коэффициентом фильтрации не менее 80% при переливании не менее 1 дм![]() консервированной крови 10-14-дневного срока хранения.
консервированной крови 10-14-дневного срока хранения.
1.3.18. Конструкция каплеобразующего элемента должна обеспечивать образование 20 капель из (1,0±0,1) г дистиллированной воды температуры (20±2)°С при скорости потока (50±5) капель в минуту.
(Измененная редакция, Изм.N 2).
1.3.19. Назначенный срок сохраняемости должен быть не менее трех лет.
За критерий предельного состояния принимают несоответствие требованиям пп.1.3.6-1.3.14.
(Измененная редакция, Изм.N 3).
1.4.1. В состав комплекта каждого эксфузионного, инфузионного и трансфузионного устройства должны входить:
основная часть;
воздуховод (для устройств с металлическими одноканальными иглами);
инъекционная игла (для инфузионных и трансфузионных устройств) в индивидуальной таре, вложенная в основную тару устройства, или без индивидуальной тары, вложенная в потребительскую тару устройства;
потребительская тара.
Основная часть, воздуховод и инъекционная игла должны быть вложены в потребительскую/основную тару. Потребительская/основная тара должна быть заварена.
Примечание. Допускается устройства инфузионные и трансфузионные в потребительской таре комплектовать иглами инъекционными в индивидуальной таре в равных количествах и вкладывать в основную тару.
(Измененная редакция, Изм.N 4).
1.5.1. На каждой потребительской таре должны быть нанесены:
наименование предприятия-изготовителя и его товарный знак;
наименование и обозначение вида устройства;
надпись: «Однократного применения»;
обозначение настоящего стандарта;
надпись: «Стерильно внутри»;
надписи: «Апирогенно», «Нетоксично»;
номер партии;
надпись: «Годен до ________________»;
(месяц, год)
текст инструкции по применению или текст раздела «Способ применения» из инструкции по применению, или рисунки, отражающие порядок работы с изделием;
надпись: «Не применять при нарушении целостности потребительской тары».
Маркировка потребительской тары должна быть устойчива в процессе стерилизации, транспортирования и хранения.
1.5.2. На каждой потребительской таре устройств, предназначенных для экспорта, на русском языке или на языке, указанном в заказе-наряде внешнеторговой организации, должны быть нанесены:
наименование и обозначение вида устройства;
надпись: «Однократного применения»;
надпись: «Стерильно внутри»;
надписи: «Апирогенно», «Нетоксично»;
номер партии;
надпись: «Годен до ________________»;
(месяц, год)
текст инструкции по применению или текст раздела «Способ применения» из инструкции по применению, или рисунки, отражающие порядок работы с изделием;
вид стерилизации;
надпись: «Сделано в ________________»;
страна-изготовитель
Маркировка потребительской тары должна быть устойчива в процессе стерилизации, транспортирования и хранения.
1.5.1, 1.5.2. (Измененная редакция, Изм.N 2, 4).
1.5.3. На упаковочном листе должны быть указаны:
наименование предприятия-изготовителя;
наименование и обозначение вида устройства;
обозначение настоящего стандарта;
номер партии;
число изделий;
фамилия или номер упаковщика.
1.5.4. На каждом ящике из гофрированного картона должны быть указаны:
наименование предприятия-изготовителя и его товарный знак;
наименование и обозначение вида устройства;
надпись: «Однократного применения»;
обозначение настоящего стандарта;
число изделий;
надпись: «Годен до ________________»;
(месяц, год)
номер партии;
надписи: «Стерильно внутри», «Апирогенно», «Нетоксично»;
вид стерилизации;
надпись: «Хранить при температуре от 5 до 40°С»;
штамп ОТК.
1.5.5. На каждом ящике с устройствами, предназначенными для экспорта, на русском языке или на языке, указанном в заказе-наряде внешнеторговой организации, должны быть указаны:
наименование и обозначение вида устройства;
надпись: «Однократного применения»;
число изделий;
надпись: «Годен до ________________»;
(месяц, год)
дата стерилизации;
надписи: «Стерильно внутри», «Апирогенно», «Нетоксично»;
номер партии;
«Сделано в __________________»;
страна-изготовитель
1.5.4, 1.5.5. (Измененная редакция, Изм.N 2, 4).
1.5.6. Транспортная маркировка — по ГОСТ 14192 с указанием на каждом транспортном ящике массы брутто и манипуляционных знаков, соответствующих надписям: «Хрупкое. Осторожно», «Беречь от влаги».
(Измененная редакция, Изм.N 4).
1.5.7. Маркировку номера партии и срока годности указывают арабскими цифрами.
1.6.1. Устройства в потребительской таре в количестве, кратном пяти, должны быть упакованы в основную тару (пакет). Пакет должен быть заварен.
Допускается по согласованию с потребителем не упаковывать устройства в потребительской таре в основную тару.
Устройства в основной или потребительской таре должны быть уложены в ящики из гофрированного картона по ГОСТ 9481, ГОСТ 13511, ГОСТ 13513, ГОСТ 13516 и ГОСТ 22852. В каждый ящик вкладывают упаковочный лист.
В ящик с устройствами, упакованными в потребительскую тару, на которой нанесены рисунки, отражающие порядок работы с изделием, должен быть вложен бумажный лист с текстом инструкции по применению или с текстом раздела «Способ применения» из инструкции по применению (1 шт. на 10 устройств). Ящик должен быть оклеен клеевой лентой на бумажной основе по ГОСТ 18251 или бумагой-основой для клеевой ленты по ГОСТ 10459.
Для отправки в районы Крайнего Севера и приравненные к ним местности, а также для длительного, многоярусного хранения упаковка должна соответствовать ГОСТ 15846.
(Измененная редакция, Изм.N 2).
1.6.3. При экспорте устройств в страны с тропическим климатом два пакета с устройствами укладывают в пакет, изготовленный из полиэтилена высокого давления по ГОСТ 16337. Пакет должен быть заварен. Пакеты с устройствами укладывают в ящик.
Ящик с устройствами должен быть вложен в пакет, изготовленный из полиэтилена высокого давления по ГОСТ 16337. Пакет должен быть заварен.
Для транспортирования ящики с устройствами должны быть уложены в контейнеры по ГОСТ 20435 или ящики по ГОСТ 24634.
Ящики должны быть обтянуты поясами из стальной упаковочной ленты по ГОСТ 3560 или уголками по ГОСТ 2364.
Стальная лента должна быть защищена стойкими антикоррозийными покрытиями.
1.6.4. При экспорте устройств в страны с умеренным климатом товаросопроводительная документация должна быть вложена в полиэтиленовый пакет, герметично заваренный. При экспорте устройств в страны с тропическим климатом, а также при морских перевозках товаросопроводительную документацию упаковывают в два полиэтиленовых пакета, вложенных один в другой. Каждый пакет должен быть заварен.
Товаросопроводительную документацию вкладывают в первый ящик отгружаемой партии. Упаковочный лист вкладывают в каждый транспортный ящик.
2. ПРИЕМКА
2.1. Для проверки соответствия требованиям настоящего стандарта устройства подвергают приемосдаточным, периодическим и сертификационным испытаниям.
(Измененная редакция, Изм.N 4).
2.2. Приемосдаточным испытаниям следует подвергать каждую партию устройств. Партией считают число устройств, простерилизованных в течение суток.
2.3. Приемосдаточные испытания проводят на соответствие требованиям всех пунктов настоящего стандарта, кроме пп.1.3.9, 1.3.15-1.3.19.
2.4. При приемосдаточных испытаниях отбор выборки устройств проводят по ГОСТ 18321 методом многоступенчатого отбора.
2.5. Приемосдаточные испытания на соответствие требованиям п.1.3.5 проводят до стерилизации на пяти устройствах.
При обнаружении хотя бы одного дефектного устройства проводят повторный отбор удвоенного числа устройств.
Результат повторного испытания является окончательным.
2.6. Приемосдаточные испытания, кроме испытаний на соответствие требованиям пп.1.3.6, 1.3.7, 1.3.10 и 1.3.13, проводят по ГОСТ 18242* выборочным контролем с применением двухступенчатого плана нормального контроля с приемочным уровнем дефектности ![]() 1,5 при уровне контроля S-3 и кодом объема выборки F или G (в зависимости от объема партии).
1,5 при уровне контроля S-3 и кодом объема выборки F или G (в зависимости от объема партии).
________________
* На территории Российской Федерации действует ГОСТ Р 50779.71-99.
Испытания на соответствие требованиям пп.1.5.1, 1.5.2, 1.3.11, 1.4, 1.2.3, 1.3.4, 1.3.2, 1.3.12, 1.3.8, 1.3.14 проводят на одних и тех же устройствах в указанной последовательности.
(Измененная редакция, Изм.N 2).
2.7. Приемосдаточные испытания на соответствие требованиям пп.1.3.6 и 1.3.7 проводят на 10 устройствах (на пяти устройствах по каждому виду испытаний).
При обнаружении в выборке хотя бы одного дефектного устройства испытаниям подвергают удвоенное число устройств из этой же партии по контролируемому параметру.
При наличии дефектов хотя бы в одном устройстве в повторной выборке всю партию считают не выдержавшей испытания.
2.8. Испытания на соответствие требованиям п.1.3.10 (в части стерильности и токсичности) и п.1.3.13 (в части стерильности) проводят при приемосдаточных и периодических испытаниях в соответствии с порядком проведения контроля стерильности стерилизованных медицинских изделий на предприятиях, «Методическими указаниями по контролю стерильности изделий медицинского назначения, стерилизованных радиационным методом» и «Методикой контроля токсичности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом» или «Методикой контроля токсичности стерильных систем комплектных эксфузионных, трансфузионных и инфузионных однократного применения», утвержденными Минздравом.
Объемы выборки для контроля стерильности и токсичности определяют по вышеуказанным методикам.
2.9. Испытания на соответствие п.1.3.10 (в части пирогенности) проводят при приемосдаточных и периодических испытаниях (один раз в год).
Объем выборки для контроля пирогенности определяют по «Методике контроля пирогенности систем комплектных эксфузионных, трансфузионных и инфузионных однократного применения» или «Методике контроля пирогенности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденным Минздравом.
2.10. Периодические испытания проводят на одной партии устройств один раз в год на соответствие требованиям настоящего стандарта, кроме пп.1.3.15-1.3.19.
Испытания на соответствие требованиям п.1.3.19 проводят один раз в три года.
Испытания на соответствие требованиям пп.1.3.15-1.3.18 проводят только на образцах из установочной серии, а также при изменении конструкции, материалов и (или) технологии изготовления, которые могут привести к снижению устойчивости изделий по контролируемым показателям.
2.8-2.10. (Измененная редакция, Изм.N 4).
2.11. Периодические испытания проводят на устройствах, прошедших приемосдаточные испытания. Отбор выборки устройств проводят по ГОСТ 18321 методом многоступенчатого отбора.
2.12. Испытания на соответствие требованиям пп.1.5.1, 1.5.2, 1.3.11, 1.4, 1.2.3, 1.3.4, 1.3.5, 1.3.2, 1.3.12, 1.3.8, 1.3.9, 1.3.14 проводят на одних и тех же пяти устройствах в указанной последовательности.
Испытания на соответствие требованиям пп.1.3.6, 1.3.7, 1.3.17, 1.3.18 проводят на пяти устройствах по каждому виду испытаний.
Испытания на соответствие требованиям пп.1.3.16, 1.3.15, 1.5, 1.6 проводят на одном ящике в указанной последовательности.
Испытания по п.1.3.19, кроме испытаний на стерильность, токсичность и пирогенность (пп.1.3.10 и 1.3.13), проводят на 13 устройствах в соответствии с нормативными документами. Объем выборки для испытаний по пп.1.3.10 и 1.3.13 (в части стерильности) определяют в соответствии с пп.2.8 и 2.9.
(Измененная редакция, Изм.N 2, 4).
2.13. Если при периодических испытаниях устройства не соответствуют хотя бы одному требованию настоящего стандарта, то должны быть проведены повторные испытания на удвоенном числе устройств. Результаты испытаний являются окончательными.
2.14. Результаты периодических испытаний должны быть оформлены протоколом.
(Измененная редакция, Изм.N 1).
2.15. Сертификационные испытания на соответствие требованиям пп.1.5.1, 1.3.11, 1.4, 1.2.3, 1.3.2, 1.3.12, 1.3.13 (в части стерильности игл) и 1.3.14 проводят на 10 устройствах в указанной последовательности.
Сертификационные испытания на соответствие требованиям пп.1.3.4 и 1.3.5 проводят на пяти устройствах; на соответствие требованиям пп.1.3.6, 1.3.7, 1.3.8, 1.3.9, 1.3.17 и 1.3.18 — на 30 устройствах (на пяти устройствах по каждому виду испытаний соответственно). Допускается проводить различные испытания на одних и тех же образцах, если это не влияет на результат.
Сертификационные испытания на соответствие токсикологической и биологической безопасности (п.1.3.10) проводят по методикам, утвержденным Минздравом.
(Введен дополнительно, Изм.N 4).
3. МЕТОДЫ ИСПЫТАНИЙ
3.1. Проверку основных размеров (п.1.2.3) следует проводить измерительными инструментами, обеспечивающими необходимую точность измерений.
3.2. Проверку прозрачности (п.1.3.2), регулирования тока жидкости (п.1.3.8), отсутствия перегибов и слипшихся участков (п.1.3.12) проводят следующим образом.
Устройство присоединяют с помощью игл к бутылке с водой вместимостью 500 см![]() , укрепленной в штативе в перевернутом положении на высоте 1 м от уровня истечения жидкости.
, укрепленной в штативе в перевернутом положении на высоте 1 м от уровня истечения жидкости.
При открытом зажиме протекание жидкости по устройству считают удовлетворительным, если происходит струйное истечение воды, а при закрытом зажиме — если обеспечивается полное перекрытие потока воды.
При прохождении жидкости должны быть видны: уровень жидкости, каплепадение и пузырьки воздуха на расстоянии не более 0,5 м.
(Измененная редакция, Изм.N 2).
3.3. Проверку на отсутствие механических повреждений и посторонних включений (п.1.3.4), комплектности (п.1.4), упаковки и маркировки (пп.1.5 и 1.6) проводят визуально невооруженным глазом.
3.4. Проверку отсутствия механических частиц на внутренней поверхности устройства после фильтра (п.1.3.5) осуществляют путем просмотра устройства невооруженным глазом на черном фоне. Источником света должны быть электрические лампы накаливания с матовым стеклом или лампы дневного света.
Наименьшая общая освещенность рабочего места — 100 лк.
Расстояние глаз контролера от просматриваемого устройства — в пределах 250 мм, направление оптической оси просмотра относительно источника света — 90°. Зрение — 1 диоптрия.
Проверка устройств должна быть проведена при просмотре соединительных трубок в течение 5 с и капельницы при ее вращении в течение 5 с.
3.5. Проверку герметичности устройства (п.1.3.6) проводят на приспособлении, оснащенном манометром с пределом измерения от 0 до 60 кПа и классом точности 0,6 или от 0 до 100 кПа и классом точности 0,4.
Основную часть устройства в собранном виде без колпачков с герметизированными отверстиями в иглах наполняют воздухом под избыточным давлением 40 кПа. Устройство считают герметичным, если падение давления в устройстве не будет превышать 0,6 кПа в течение 1 мин.
Допускается испытания проводить под водой, при этом не должно быть утечки воздуха при создании внутри избыточного давления 40 кПа в течение 1 мин.
При проведении испытаний в инфузионных и трансфузионных устройствах инъекционную иглу следует снимать.
(Измененная редакция, Изм.N 2).
3.6. Проверку прочности соединения (п.1.3.7) проводят на разрывных машинах по ГОСТ 28840 или других с аналогичными характеристиками при скорости перемещения нижнего зажима 50-100 мм/мин путем приложения осевой нагрузки 50 и 20 Н соответственно.
Устройство считают выдержавшим испытания, если не наблюдается нарушения соединения при нагрузках, указанных выше.
3.7. Проверка самозатягиваемости инъекционного узла (п.1.3.9)
Емкость с водой вместимостью 500 см![]() , соединенную с инфузионным или трансфузионным устройством, подвешивают на высоте 1 м. Устройство заполняют водой. В инъекционный узел вводят иглу диаметром 0,8 мм в разных местах. После извлечения иглы через место прокола не должно происходить истечения жидкости.
, соединенную с инфузионным или трансфузионным устройством, подвешивают на высоте 1 м. Устройство заполняют водой. В инъекционный узел вводят иглу диаметром 0,8 мм в разных местах. После извлечения иглы через место прокола не должно происходить истечения жидкости.
3.8. Проверка стерильности, пирогенности и токсичности (пп.1.3.10, 1.3.13)
Стерильность устройств проверяют в соответствии с порядком проведения контроля стерильности стерилизованных медицинских изделий на предприятиях и «Методическими указаниями по контролю стерильности изделий медицинского назначения, стерилизованных радиационным методом», утвержденными Минздравом.
Пирогенность устройств проверяют в соответствии с «Методикой контроля пирогенности систем комплектных эксфузионных, трансфузионных и инфузионных однократного применения» или «Методикой контроля пирогенности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденными Минздравом.
Токсичность устройств проверяют в соответствии с «Методикой контроля токсичности стерильных систем комплектных эксфузионных, трансфузионных и инфузионных однократного применения» или «Методикой контроля токсичности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом», утвержденными Минздравом.
(Измененная редакция, Изм.N 4).
3.9. Проверка целостности потребительской тары (п.1.3.11)
Целостность потребительской тары определяют визуально: не должно быть видимых повреждений тары.
3.10. Проверка фильтра воздуховода (п.1.3.14)
Основную часть трансфузионного или инфузионного устройства с воздуховодом согласно инструкции по применению присоединяют с помощью игл к емкости с водой вместимостью 500 см![]() , укрепленной в штативе в перевернутом положении на высоте 1 м. При открытом зажиме переливание из емкости должно быть не более чем за 10 мин.
, укрепленной в штативе в перевернутом положении на высоте 1 м. При открытом зажиме переливание из емкости должно быть не более чем за 10 мин.
Основную часть эксфузионного устройства с воздуховодом присоединяют к пустой емкости согласно инструкции по применению, трубку устройства пережимают зажимом. Иглу донора устройства присоединяют к емкости с водой вместимостью 500 см![]() , укрепленной в штативе в перевернутом положении на высоте 0,7 м и снабженной воздуховодом без фильтра. Открывают зажим.
, укрепленной в штативе в перевернутом положении на высоте 0,7 м и снабженной воздуховодом без фильтра. Открывают зажим.
При открытом зажиме переливание из емкости должно быть осуществлено не более чем за 5 мин.
3.11. Проверку устройств на вибропрочность и ударопрочность (п.1.3.15) следует проводить в соответствии с ГОСТ 20790.
После окончания испытаний проводят проверку устройств на соответствие требованиям пп.1.3.6-1.3.8 и 1.3.11. Проверку проводят на пяти устройствах, отобранных из разных мест транспортной тары.
3.12. Проверку тепло- и холодоустойчивости (п.1.3.16) следует проводить по ГОСТ 20790. Испытания проводят при двух значениях температуры транспортирования по п.1.3.16 в течение 4 ч с момента достижения номинального режима.
После испытаний каждого вида устройства извлекают из камеры и выдерживают в нормальных условиях в течение 4 ч. После проведения испытаний устройства должны соответствовать требованиям пп.1.3.6, 1.3.7, 1.3.11. Испытания по каждому показателю проводят на пяти устройствах, отобранных из разных мест ящика.
3.13. Проверку влагоустойчивости устройств (п.1.3.16) следует проводить по ГОСТ 20790. Допускается проводить испытания влагоустойчивости в потребительской таре в течение 1 сут. После проведения испытаний устройства должны соответствовать требованиям пп.1.3.6-1.3.8, 1.3.11. Испытания проводят на пяти устройствах, отобранных из разных мест ящика.
3.9-3.13. (Измененная редакция, Изм.N 2).
3.14. Проверку капельно-фильтрующего узла (п.1.3.17) проводят по методике, утвержденной в установленном порядке.
3.15. Проверка каплеобразования (п.1.3.18)
Заполняют стеклянную бутылку вместимостью 250 см![]() до номинала дистиллированной водой, имеющей температуру (20±2)°С. Закрывают бутылку резиновой пробкой. К бутылке с дистиллированной водой присоединяют основную часть устройства с помощью иглы путем прокола резиновой пробки. Взвешивают 5 пронумерованных стеклянных бюкс или колбочек с точностью до 0,001 г.
до номинала дистиллированной водой, имеющей температуру (20±2)°С. Закрывают бутылку резиновой пробкой. К бутылке с дистиллированной водой присоединяют основную часть устройства с помощью иглы путем прокола резиновой пробки. Взвешивают 5 пронумерованных стеклянных бюкс или колбочек с точностью до 0,001 г.
Заполненную дистиллированной водой бутылку с подсоединенным к ней устройством укрепляют в штативе в перевернутом виде и заполняют устройство водой в соответствии с инструкцией по применению до полного вытеснения воздуха из устройства.
Регулируют зажимом скорость истечения воды, устанавливая режим каплепадения в капельно-фильтрующем узле равным (50±5) капель/мин.
При устоявшемся режиме падения капель подставляют стеклянную бюксу или колбочку к инъекционной игле либо к головке с конусом устройства, одновременно начиная отсчет капель в капельно-фильтрующем узле. Отсчитывают 20 капель, колбочку или бюксу закрывают крышкой или притертой пробкой, обтирают бюксу от капель влаги снаружи и взвешивают на аналитических весах с точностью до 0,001 г.
(Измененная редакция, Изм.N 2).
3.16. Проверку установленного срока сохраняемости (п.1.3.19) проводят по нормативным документам закладкой устройств на опытное хранение в течение трех лет в условиях, предусмотренных настоящим стандартом.
(Измененная редакция, Изм.N 4).
4. ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
4.1.1. Устройства в упакованном виде транспортируют транспортом всех видов в крытых транспортных средствах в соответствии с правилами перевозки грузов, действующими на транспорте каждого вида.
Устройства транспортируют морским путем в соответствии с «Правилами безопасности морской перевозки грузов». Вид отправки — контейнеры по ГОСТ 20435 с коэффициентом использования 0,9. Условия транспортирования устройств внутри страны и в районы с умеренным климатом должны соответствовать группе 5 ГОСТ 15150.
После транспортирования в условиях отрицательных температур устройства в транспортной таре должны быть выдержаны при нормальных климатических условиях не менее 24 ч.
4.1.2. Условия транспортирования устройств, предназначенных для экспорта в страны с тропическим климатом, а также при морских перевозках должны соответствовать группе 6 ГОСТ 15150.
4.2. Хранение
Условия хранения устройств в упаковке предприятия-изготовителя — группа 1 по ГОСТ 15150.
При хранении ящики с устройствами должны быть уложены по высоте, обеспечивающей их целостность.
5. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
5.1. Изготовитель гарантирует соответствие устройств требованиям настоящего стандарта при соблюдении условий транспортирования и хранения.
5.2. Гарантийный срок хранения — 3 года со времени стерилизации.
ПРИЛОЖЕНИЕ 1 (обязательное). ВИДЫ УСТРОЙСТВ
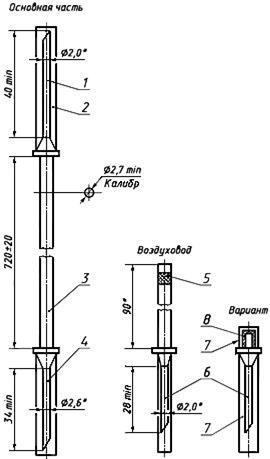
Черт.1. Устройство для взятия крови в бутылку ВК 10-01
Устройство для взятия крови в бутылку ВК 10-01
________________
* Размеры для справок.
1 — инъекционная игла; 2, 7 — колпачок; 3 — трубка; 4 — игла к емкости (с боковым отверстием); 5, 8 — фильтр; 6 — игла воздуховода (с боковым отверстием)
Черт.1
Черт.2. Устройство для вливания кровезаменителей и инфузионных растворов ПР 11-01
Устройство для вливания кровезаменителей и инфузионных растворов ПР 11-01
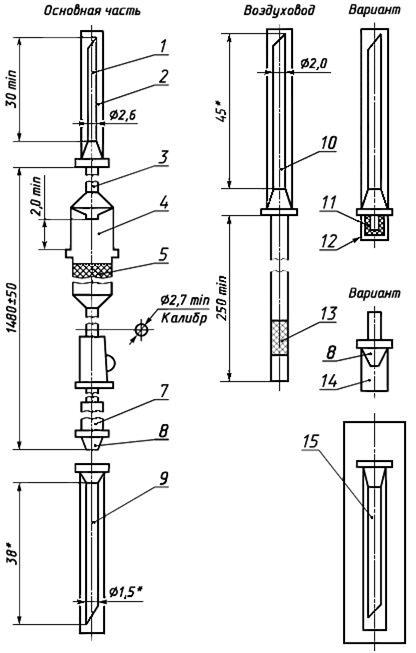
1 — игла к емкости (с боковым отверстием); 2, 14 — колпачок; 3 — трубка; 4 — капельница; 5 -фильтрующий узел; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — инъекционная игла с конусом «Рекорд или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11 — насадка; 12, 13 — фильтр ; 15 — инъекционная игла в индивидуальной таре
Черт.2
Черт.3. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 11-01, ПК 11-05
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 11-01, ПК 11-05
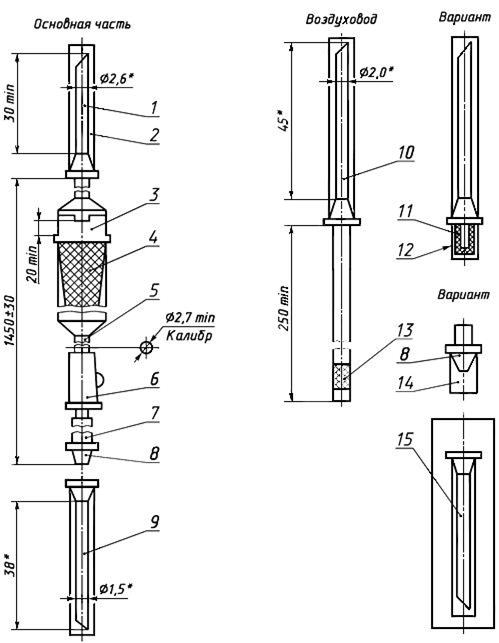
1 — игла к емкости (с боковым отверстием); 2, 14 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5 — трубка; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — инъекционная игла с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11, 13 — фильтр; 12 — насадка; 15 — инъекционная игла в индивидуальной таре
Черт.3
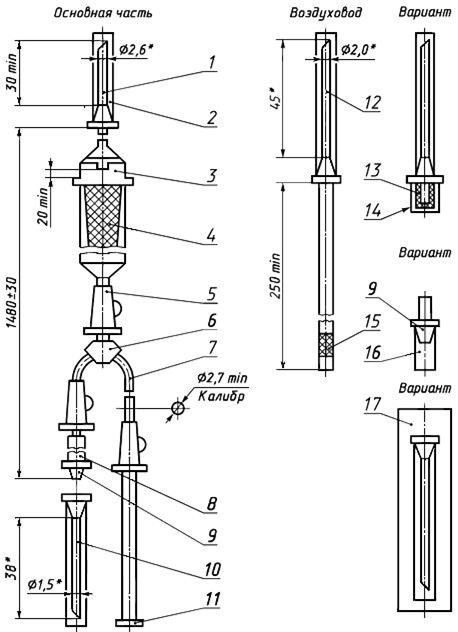
Черт.4. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 11-03 (с одновременным измерением венозного давления)
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 11-03 (с одновременным измерением венозного давления)
________________
* Размеры для справок.
1 — игла к емкости (с боковым отверстием); 2, 16 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5 — зажим; 6 — тройник; 7 — трубка; 8 — инъекционный узел; 9 — головка с конусом «Рекорд» или «Луер»; 10 — инъекционная игла с конусом «Рекорд» или «Луер»; 11 — наконечник; 12 — игла воздуховода (с боковым отверстием); 13, 15 — фильтр; 14 — насадка; 17 — инъекционная игла в индивидуальной таре
Черт.4
Черт.5. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 21-01
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 21-01
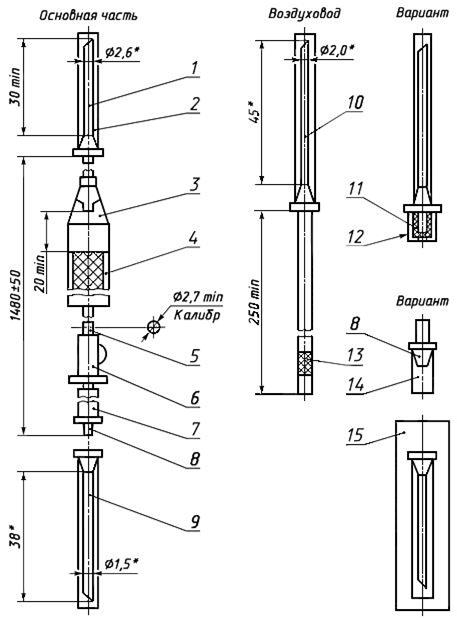
________________
* Размеры для справок
1 — игла к емкости (с боковым отверстием); 2, 14 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5 — трубка; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — инъекционная игла с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11, 13 — фильтр; 12 — насадка; 15 — инъекционная игла в индивидуальной таре
Черт.5
Черт.6. Устройство для переливания крови и компонентов крови из контейнеров ПК 22-02
Устройство для переливания крови и компонентов крови из контейнеров ПК 22-02
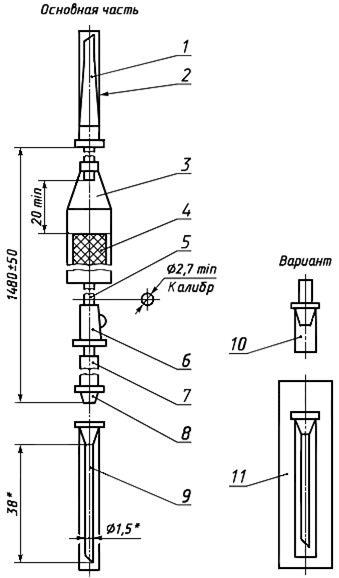
________________
* Размеры для справок.
1 — полимерная игла к штуцеру контейнера; 2, 10 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5 — трубка; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — инъекционная игла с конусом «Рекорд» или «Луер»; 11 — инъекционная игла в индивидуальной таре
Черт.6
Черт.7. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 23-02
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 23-02

________________
* Размеры для справок
1 — совмещенная игла к емкости; 2, 11, 14 — колпачок; 3 — фильтр; 4, 12 — заглушка; 5 — капельница; 6 — фильтрующий узел; 7 — трубка; 8 — зажим; 9 — инъекционный узел; 10 — головка с конусом «Рекорд» или «Луер»; 13 — инъекционная игла с конусом «Рекорд» или «Луер»; 15 — инъекционная игла в индивидуальной таре
Черт.7
Черт.8. Устройство комбинированное для переливания крови, кровезаменителей и инфузионных растворов КР 11-01
Устройство комбинированное для переливания крови, кровезаменителей и инфузионных растворов КР 11-01
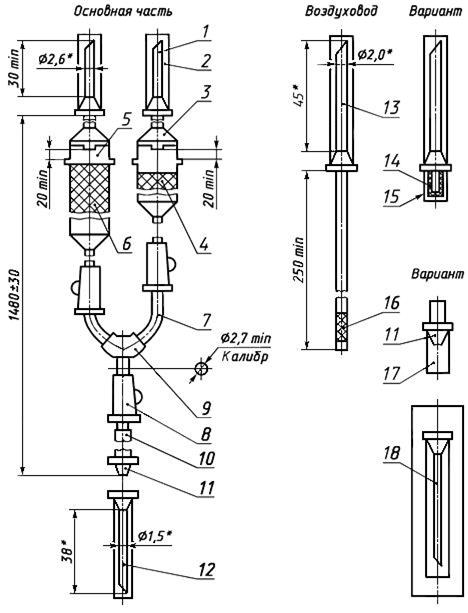
________________
* Размеры для справок.
1 — игла к емкости (с боковым отверстием); 2, 17 — колпачок; 3, 5 — капельница; 4, 6 — фильтрующий узел; 7 — трубка; 8 — зажим; 9 — тройник; 10 — инъекционный узел; 11 — головка с конусом «Рекорд» или «Луер»; 12 — инъекционная игла; 13 — игла воздуховода (с боковым отверстием); 14, 16 — фильтр; 15 — насадка; 18 — инъекционная игла в индивидуальной таре
Черт.8
Черт.9. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 21-05
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 21-05
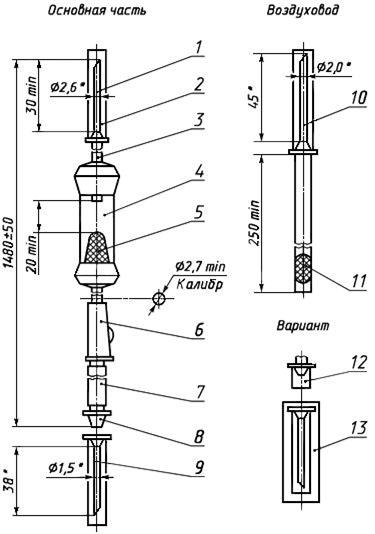
________________
* Размеры для справок.
1 — игла для емкости (с боковым отверстием); 2, 12 — каплачок; 3 — трубка; 4 — капельница; 5 — фильтрующий узел; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — игла с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11 — фильтр; 13 — инъекционная игла в индивидуальной таре
Черт.9
Черт.10. Устройство для вливания кровезаменителей и инфузионных растворов ПР 21-05
Устройство для вливания кровезаменителей и инфузионных растворов ПР 21-05
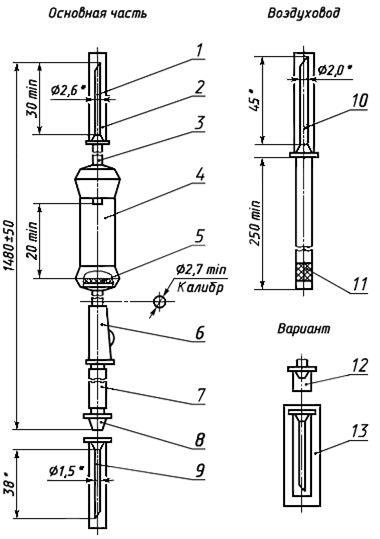
________________
* Размеры для справок.
1 — игла для емкости (с боковым отверстием); 2, 12 — колпачок; 3 — трубка; 4 — капельница; 5 — фильтрующий узел; 6 — зажим; 7 — инъекционный узел; 8 — головка с конусом «Рекорд» или «Луер»; 9 — инъекционная игла с конусом «Рекорд» или «Луер»; 10 — игла воздуховода (с боковым отверстием); 11 — фильтр; 13 — инъекционная игла в индивидуальной таре
Черт.10
Черт.11. Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 23-05
Устройство для переливания крови, кровезаменителей и инфузионных растворов ПК 23-05
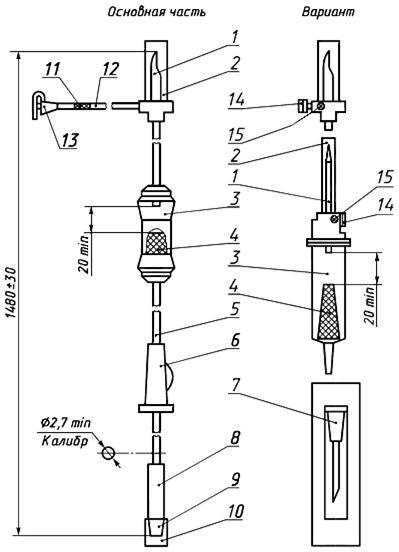
1 — совмещенная игла; 2, 10 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5, 12 — трубка; 6 — зажим; 7 — инъекционная игла в индивидуальной таре; 8 — инъекционный узел; 9 — головка с конусом «Луер»; 11, 15 — фильтр; 13, 14 — головка с заглушкой
Черт.11
Черт.12. Устройство для вливания кровезаменителей и инфузионных растворов ПР 23-05
Устройство для вливания кровезаменителей и инфузионных растворов ПР 23-05
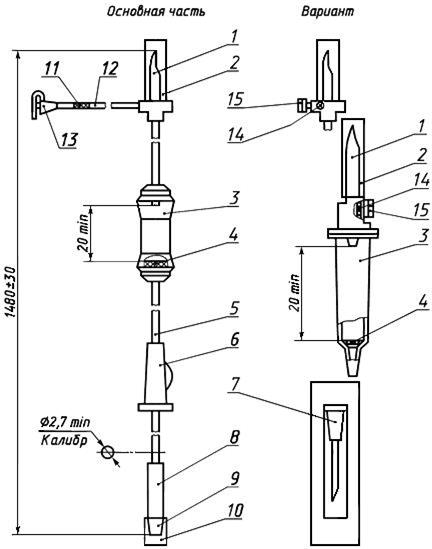
1 — совмещенная игла; 2, 10 — колпачок; 3 — капельница; 4 — фильтрующий узел; 5, 12 — трубка; 6 — зажим; 7 — инъекционная игла в индивидуальной таре; 8 — инъекционный узел; 9 — головка с конусом «Луер»; 11, 14 — фильтр; 13, 15 — головка с заглушкой
Черт.12
ПРИЛОЖЕНИЕ 1. (Измененная редакция, Изм.N 1, 2, 3, 4).







